10º
Agosto 23, de 2020
Tema 1. Fluidos en reposo
La Hidrostática es la rama de la mecánica de los fluidos que
estudia las leyes que rigen el comportamiento de líquidos y gases en reposo; es decir, cuando no hay
fuerzas externas que alteren su
equilibrio.
Los fluidos en reposo ejercen fuerza sobre las paredes de los recipientes que los contienen y también sobre cualquier objeto que se encuentre sumergido en ellos. Esa fuerza actúa sobre una superficie de manera proporcional a lo que llamaremos presión hidrostática.
La densidad y presión
La presión ejercida en un fluido estático depende solamente de la profundidad del fluido, la densidad del fluido y la aceleración de la gravedad.
| Pfl. estático = ρgh en donde | ρ = m/V = densidad de fluido g = aceleración de la gravedad h = profundidad del fluido |
Densidad
La densidad de un pequeño elemento de cualquier material es igual a la masa Δm del elemento dividido por su volumen ΔV.
La densidad de un material depende de factores ambientales, incluyendo la temperatura y la presión, aunque para líquidos y sólidos la variación de la densidad es muy pequeña para amplios rangos de variación de la temperatura y la presión y para muchas aplicaciones se puede considerar constante.
Tabla de densidades de algunas sustancias comunes
La presión en los líquidos
La presión hidrostática es la fuerza que ejerce un liquido en reposo sobre las paredes del recipiente que lo contiene y sobre cualquier cuerpo que se encuentre sumergido. Si el líquido fluyera, las fuerzas resultantes de las presiones ya no serían necesariamente perpendiculares a las superficies. Esta presión depende de la densidad del líquido en cuestión y de la altura a la que esté sumergido el cuerpo y se calcula mediante la siguiente expresión:
P=pgh
La presión se encuentra en pascales (Pa=N/m2)
p es la densidad del líquido (kg/m2)
g es la aceleración de la gravedad (m/s2)
h es la altura del fluido (m) Un líquido en equilibrio ejerce fuerzas perpendiculares sobre cualquier superficie sumergida en su interior.
El principio de Pascal
El principio de Pascal es una ley enunciada por el físico y matemático francés Blas Pascal (1623–1662) que se resume en la frase ''la presión ejercida en cualquier lugar de un fluido encerrado e incompresible se transmite por igual en todas las direcciones en todo el fluido'', es decir, la presión en todo el fluido es constante.
El principio de Pascal puede comprobarse utilizando una esfera hueca, perforada en diferentes lugares y provista de un compresor. Al llenar la esfera con agua y ejercer presión sobre ella mediante el compresor, se observa que el agua sale por todos los agujeros con la misma velocidad y por lo tanto con la misma presión.

También se puede comprobar fácilmente con una jeringuilla, llénala de aire, empuja el émbolo y veras cómo se comprime el aire que está en su interior, a continuación llénala de agua (sin que quede ninguna burbuja de aire) observarás que por mucho esfuerzo que hagas no hay manera de mover en émbolo, los líquidos son incompresibles.
Algunas aplicaciones conocidas son:
Los gatos hidráulicos utilizan el principio de pascal.
El tren de aterrizaje de los aviones.
Los submarinos utilizan el principio de Pascal para ascender y descender.
Los frenos hidráulicos son una aplicación del principio de Pascal: ejercemos una fuerza con el pie en un émbolo pequeño y el fluido la transmite y, según la relación entre las secciones de los émbolos, la amplifica.
El principio de Arquímedes
- E es el empuje.
- m la masa.
- g la aceleración de la gravedad.
- ρf es la densidad del fluido
- V el volumen del fluido desplazado.
La presión en los gases
1- La presión de los gases
La medida del efecto que una fuerza ejerce sobre una superficie es la presión (P) y corresponde a la relación entre el valor de la fuerza (F) y el área de contacto (A).
P= F / A
Por lo tanto la presión depende de dos factores:
- La fuerza aplicada (F): mientras mayor es la fuerza mayor es la presión y el efecto sobre el cuerpo que la recibe. La fuerza se mide en Newton (N)
- El área (A): Cuanto menor sea la superficie, mayor es la presión, y por lo tanto, es más intenso el efecto de la fuerza sobre el cuerpo que la recibe. El área se mide en metros cuadrados (m2)
En los gases esta fuerza actúa en forma uniforme sobre todas las partes del recipiente.

Torricelli razonó que la columna de mercurio no caía debido a que la presión atmosférica ejercida sobre la superficie del mercurio (y transmitida a todo el líquido y en todas direcciones) era capaz de equilibrar la presión ejercida por su peso.
Como la presión era directamente proporcional a la altura de la columna de mercurio (h), se adoptó como medida de la presión el mm de mercurio.
Así la presión considerada como "normal" se correspondía con una columna de altura 760 mm.
La presión atmosférica se puede medir también en atmósferas (atm):
1 atm=760 mm=101.325 Pa =1,0 “kilo” (kgf/cm2)
Webgrafía
Septiembre 03, de 2020Tema 2. Fluidos en movimiento
Se llaman fluidos a un conjunto de sustancias donde existe entre sus moléculas poca fuerza de atracción, cambiando su forma. Lo que ocasiona que la posición que toman las moléculas varia, ante una fuerza aplicada sobre ellas, ya que estos fluyen
En algunas ocasiones los líquidos toman la forma del recipiente que los aloja, manteniendo su propio volumen . Los gases carecen tanto de volumen como de forma propia.Las variables del estado del material son: presión - densidad - velocidadEcuación de continuidad
Cuando un fluido fluye por un conducto de diámetro variable, su velocidad cambia debido a que la sección transversal varía de una sección del conducto a otra.
En todo fluido incompresible, con flujo estacionario (en régimen laminar), la velocidad de un punto cualquiera de un conducto es inversamente proporcional a la superficie, en ese punto, de la sección transversal de la misma.
La ecuación de continuidad no es más que un caso particular del principio de conservación de la masa. Se basa en que el caudal (Q) del fluido ha de permanecer constante a lo largo de toda la conducción.
Dado que el caudal es el producto de la superficie de una sección del conducto por la velocidad con que fluye el fluido, tendremos que en dos puntos de una misma tubería se debe cumplir que:

- S es la superficie de las secciones transversales de los puntos 1 y 2 del conducto.
- v es la velocidad del flujo en los puntos 1 y 2 de la tubería.
En la imagen de la derecha puedes ver como la sección se reduce de A1 a A2. Teniendo en cuenta la ecuación anterior:

Es decir la velocidad en el estrechamiento aumenta de forma proporcional a lo que se reduce la sección.

Que es la ecuación de continuidad y donde:Se puede concluir que puesto que el caudal debe mantenerse constante a lo largo de todo el conducto, cuando la sección disminuye, la velocidad del flujo aumenta en la misma proporción y viceversa.
Ecuación
de Bernoulli
El principio de Bernoulli, también
denominado ecuación de Bernoulli o Trinomio de Bernoulli, describe el
comportamiento de un fluido moviéndose a lo largo de una línea de corriente.
Fue expuesto por Daniel Bernoulli en su obra Hidrodinámica (1738) y expresa que
en un fluido ideal (sin viscosidad ni rozamiento) en régimen de circulación por
un conducto cerrado, la energía que posee el fluido permanece constante a lo
largo de su recorrido. La energía de un fluido en cualquier momento consta de
tres componentes:
Cinética: es la energía debida a la velocidad que posea el fluido.
Potencial gravitacional: es la energía debido a la altitud que un fluido posea.
Energía de flujo: es la energía que un fluido contiene debido a la presión que posee.
La siguiente ecuación conocida como "Ecuación de Bernoulli" (Trinomio de Bernoulli) consta de estos mismos términos.
1/2 V2 ρ + P + ρgz = constante
- V = velocidad del fluido en la sección considerada.
- g = aceleración gravitatoria
- z = altura en la dirección de la gravedad desde una cota de
referencia.
- P = presión a lo largo de la línea de corriente.
- ρ = densidad del fluido.
Aplicaciones
de la ecuación de Bernoulli
Esta ecuación se aplica en la dinámica de fluidos. Un fluido se caracteriza por carecer de elasticidad de forma, es decir, adopta la forma
del recipiente que la contiene, esto se debe a que las moléculas de los fluidos no están rígidamente unidas, como en el caso de los sólidos. Fluidos son tanto
gases como líquidos. Para llegar a la ecuación de Bernoulli se han de hacer
ciertas suposiciones que nos limitan el nivel de aplicabilidad:
El fluido se mueve en un régimen estacionario, o sea, la
velocidad del flujo en un punto no varía con el tiempo.
Se desprecia la viscosidad del fluído (que es una fuerza de
rozamiento interna).
Se considera que el líquido está bajo la acción del campo
gravitatorio únicamente.
Webgrafía
1. https://es.slideshare.net/danicardonah/fluidos-en-movimiento-15077635Tema 2. Fluidos en movimiento
Ecuación de continuidad
Cuando un fluido fluye por un conducto de diámetro variable, su velocidad cambia debido a que la sección transversal varía de una sección del conducto a otra.
En todo fluido incompresible, con flujo estacionario (en régimen laminar), la velocidad de un punto cualquiera de un conducto es inversamente proporcional a la superficie, en ese punto, de la sección transversal de la misma.
La ecuación de continuidad no es más que un caso particular del principio de conservación de la masa. Se basa en que el caudal (Q) del fluido ha de permanecer constante a lo largo de toda la conducción.
Dado que el caudal es el producto de la superficie de una sección del conducto por la velocidad con que fluye el fluido, tendremos que en dos puntos de una misma tubería se debe cumplir que:
- S es la superficie de las secciones transversales de los puntos 1 y 2 del conducto.
- v es la velocidad del flujo en los puntos 1 y 2 de la tubería.
En la imagen de la derecha puedes ver como la sección se reduce de A1 a A2. Teniendo en cuenta la ecuación anterior: Es decir la velocidad en el estrechamiento aumenta de forma proporcional a lo que se reduce la sección. |
Se puede concluir que puesto que el caudal debe mantenerse constante a lo largo de todo el conducto, cuando la sección disminuye, la velocidad del flujo aumenta en la misma proporción y viceversa.
Ecuación de Bernoulli
El principio de Bernoulli, también denominado ecuación de Bernoulli o Trinomio de Bernoulli, describe el comportamiento de un fluido moviéndose a lo largo de una línea de corriente. Fue expuesto por Daniel Bernoulli en su obra Hidrodinámica (1738) y expresa que en un fluido ideal (sin viscosidad ni rozamiento) en régimen de circulación por un conducto cerrado, la energía que posee el fluido permanece constante a lo largo de su recorrido. La energía de un fluido en cualquier momento consta de tres componentes:
Cinética: es la energía debida a la velocidad que posea el fluido.
Potencial gravitacional: es la energía debido a la altitud que un fluido posea.
Energía de flujo: es la energía que un fluido contiene debido a la presión que posee.
La siguiente ecuación conocida como "Ecuación de Bernoulli" (Trinomio de Bernoulli) consta de estos mismos términos.
- V = velocidad del fluido en la sección considerada.
- g = aceleración gravitatoria
- z = altura en la dirección de la gravedad desde una cota de referencia.
- P = presión a lo largo de la línea de corriente.
- ρ = densidad del fluido.
Aplicaciones de la ecuación de Bernoulli
Esta ecuación se aplica en la dinámica de fluidos. Un fluido se caracteriza por carecer de elasticidad de forma, es decir, adopta la forma del recipiente que la contiene, esto se debe a que las moléculas de los fluidos no están rígidamente unidas, como en el caso de los sólidos. Fluidos son tanto gases como líquidos. Para llegar a la ecuación de Bernoulli se han de hacer ciertas suposiciones que nos limitan el nivel de aplicabilidad:
El fluido se mueve en un régimen estacionario, o sea, la velocidad del flujo en un punto no varía con el tiempo.
Se desprecia la viscosidad del fluído (que es una fuerza de rozamiento interna).
Se considera que el líquido está bajo la acción del campo gravitatorio únicamente.
Webgrafía
2. https://www.ecured.cu/Ecuaci%C3%B3n_de_Bernoulli#Formulaci.C3.B3n_de_la_ecuaci.C3.B3n
Septiembre 10, de 2020
Tema 3. Calor y temperatura
En ocasiones utilizamos los términos calor y temperatura para referirnos a lo mismo de forma errónea. Científicamente hablando el calor y la temperatura se encuentran relacionados entre si aunque representan conceptos diferentes.
La temperatura mide la energía térmica que contiene un cuerpo. Un cuerpo caliente tendrá una temperatura mayor que un cuerpo frío. Concretamente la temperatura mide la vibración o la energía interna de las partículas que componen ese cuerpo de forma que un cuerpo más caliente tendrá una temperatura mayor. Así pues podríamos definir temperatura como la medición de la actividad molecular del objeto.
Calor por otra parte es la transferencia de energía térmica de un cuerpo a otro de menor temperatura. El calor siempre fluye desde el cuerpo con mayor temperatura hacia el de menor temperatura y no deja de transferirse hasta que los dos cuerpos se igualan en temperatura y quedan en equilibrio.
Equilibrio térmico
En física, se llama equilibrio térmico al estado en que dos cuerpos en contacto, o separados por una superficie conductora, igualan sus temperaturas inicialmente dispares, debido a la transferencia de calor de uno hacia el otro.
Si tenemos dos objetos en contacto, uno más caliente que otro, a medida que el tiempo transcurra ambos tenderán a alcanzar la misma temperatura y, si no hay transferencia de calor hacia otros objetos, en adelante mantendrán un equilibrio térmico, o sea, una temperatura constante
Este fenómeno puede explicarse microscópicamente, comprendiendo que la temperatura de los objetos está directamente relacionada con la energía cinética promedio de sus partículas, sean átomos, moléculas, o los que convenga considerar.
Fórmula del equilibrio térmico
La expresión del equilibrio térmico involucra el cálculo de la diferencia de temperaturas entre los dos cuerpos, por lo que debe determinarse la cantidad de calor (Q) que intercambian.
En ocasiones utilizamos los términos calor y temperatura para referirnos a lo mismo de forma errónea. Científicamente hablando el calor y la temperatura se encuentran relacionados entre si aunque representan conceptos diferentes.
La temperatura mide la energía térmica que contiene un cuerpo. Un cuerpo caliente tendrá una temperatura mayor que un cuerpo frío. Concretamente la temperatura mide la vibración o la energía interna de las partículas que componen ese cuerpo de forma que un cuerpo más caliente tendrá una temperatura mayor. Así pues podríamos definir temperatura como la medición de la actividad molecular del objeto.
Calor por otra parte es la transferencia de energía térmica de un cuerpo a otro de menor temperatura. El calor siempre fluye desde el cuerpo con mayor temperatura hacia el de menor temperatura y no deja de transferirse hasta que los dos cuerpos se igualan en temperatura y quedan en equilibrio.
Equilibrio térmico
En física, se llama equilibrio térmico al estado en que dos cuerpos en contacto, o separados por una superficie conductora, igualan sus temperaturas inicialmente dispares, debido a la transferencia de calor de uno hacia el otro.
Si tenemos dos objetos en contacto, uno más caliente que otro, a medida que el tiempo transcurra ambos tenderán a alcanzar la misma temperatura y, si no hay transferencia de calor hacia otros objetos, en adelante mantendrán un equilibrio térmico, o sea, una temperatura constante
Este fenómeno puede explicarse microscópicamente, comprendiendo que la temperatura de los objetos está directamente relacionada con la energía cinética promedio de sus partículas, sean átomos, moléculas, o los que convenga considerar.
Fórmula del equilibrio térmico
La expresión del equilibrio térmico involucra el cálculo de la diferencia de temperaturas entre los dos cuerpos, por lo que debe determinarse la cantidad de calor (Q) que intercambian.
Esto se determina empleando la fórmula Q = m . Ce . Δt, en donde m será la masa del cuerpo, Ce su calor específico expresado en cal / gr °C, y Δt la variación de temperatura, o sea: Δt = tf – ti, tiempo final menos tiempo inicial.
Una vez calculado el calor Q para cada cuerpo, podremos compararlos a sabiendas de que el equilibrio térmico se da en la igualdad de las temperaturas entre el cuerpo 1 y el cuerpo 2. Para llegar al equilibrio térmico, el calor que el cuerpo más frío gana es el que el cuerpo más caliente pierde, así que Q1 = Q2, o sea, calor ganado = calor perdido.
Transmisión del calor
En general,
se reconocen tres modos distintos de transferencia de calor: conducción,
convección y radiación, aunque, en rigor, solo la conducción y radiación
debieran considerarse formas de transmisión de calor, porque solo ellas
dependen exclusivamente de un desequilibrio térmico para producirse. Para que
se produzca convección, tiene que haber un transporte mecánico de masa además
de una diferencia de temperatura, sin embargo, teniendo en cuenta que la
convección también transfiere energía de zonas con mayor temperatura a zonas
con menor temperatura, normalmente se admite el modo transferencia de calor por
convección.
Conducción:
Es la transferencia de calor que se produce a través de un medio material por
contacto directo entre sus partículas, cuando existe una diferencia de
temperatura y en virtud del movimiento de sus micropartículas. El medio puede
ser sólido, líquido o gaseoso, aunque en líquidos y gases solo se da la
conducción pura si se excluye la posibilidad de convección. La cantidad de
calor que se transfiere por conducción, viene dada por la ley de Fourier. Esta
ley afirma que la velocidad de conducción de calor a través de un cuerpo por
unidad de sección transversal, es proporcional al gradiente de temperatura que
existe en el cuerpo.
Convección:
La transmisión de calor por convección se compone de dos mecanismos
simultáneos. El primero, es la transferencia de calor por conducción, debido al
movimiento molecular, a la que se superpone la transferencia de energía por el
movimiento de fracciones del fluido que se mueven accionadas por una fuerza
externa, que puede ser un gradiente de densidad (convección natural), o una
diferencia de presión producida mecánicamente (convección forzada) o una
combinación de ambas. La cantidad de calor transferido por convección, se rige
por la ley de enfriamiento de Newton.
Radiación:
Se puede atribuir a cambios en las configuraciones electrónicas de los átomos o
moléculas constitutivas. En ausencia de un medio, existe una transferencia neta
de calor por radiación entre dos superficies a diferentes temperaturas, debido
a que todas las superficies con temperatura finita emiten energía en forma de
ondas electromagnéticas. El calor emitido por una superficie en la unidad de
tiempo, viene dado por la ley de Stefan-Boltzmann.

Dilatación térmica
La
dilatación térmica es el proceso por el cual los cuerpos aumentan su volumen
cuando se aumenta su temperatura.
Cuando en
lugar de aumentar, la temperatura disminuye, el volumen del cuerpo también lo
hace, hablándose en estos casos de contracción térmica.
Estos
fenómenos son especialmente importantes a la hora de fabricar determinadas
estructuras como por ejemplo las vías de tren. Las industrias que fabrican los
rieles los entregan con una longitud de unos 12 m. Es necesario unirlos
(generalmente abulonados) para formar las vías. Durante el día la temperatura
ambiente que pueden llegar a soportar ronda entorno a los 40° e incluso el
acero puede alcanzar una temperatura muy superior. Dicha temperatura provoca
dilataciones en las vías favoreciendo que en las uniones se provoquen
deformaciones. Por esta razón,
justamente en dichas uniones se deja una separación de unos 5 mm
denominado junta de dilatación.

El problema
de esta separación es que es incompatible con el desplazamiento de los trenes
de alta velocidad (250 km/h) ya que generan mucho ruido al circular el tren por
ellas y las ruedas y rieles sufrirían roturas. La tecnología moderna ha logrado
soldaduras especiales que absorben las dilataciones, por lo tanto hay tramos de
muchos kilómetros (varias decenas) sin separaciones aunque en las cercanías de
las estaciones de ferrocarril se siguen utilizando ya que por esas zonas los
trenes deben disminuir mucho su velocidad.
Webgrafía
1. http://www.expower.es/calor-temperatura.htm 2. https://concepto.de/equilibrio-termico/ 3. https://es.wikipedia.org/wiki/Transferencia_de_calor#:~:text=En%20general%2C%20se%20reconocen%20tres,un%20desequilibrio%20t%C3%A9rmico%20para%20producirse.
Septiembre 17, de 2020Tema 4. Fases de la materia
La materia puede existir en varias formas o estados de agregación diferentes, conocidos como fases, dependiendo del volumen y de la presión y temperatura ambiente. Una fase es una forma de materia que tiene una composición química y unas propiedades físicas relativamente uniformes. Estas fases incluyen las tres familiares (sólidos, líquidos, y gases), así como otros estados más exóticos de la materia (como plasmas, superfluidos, supersólidos).
Cada fase es estable solo en ciertos intervalos de temperatura y presión. La transición de una fase a otra normalmente seda en condiciones de equilibrio de fases entre las dos fases y, para una presión dada, esto solo ocurre a una temperatura específica. Podemos representar estas condiciones en una grafica con ejes p y T, llamada diagrama de fases.![]() Cada punto del diagrama representa un par de valores de p y T (presión y temperatura). En cada punto, sólo puede existir una fase, excepto sobre las líneas, donde pueden coexistir dos fases en equilibrio de fases.
Cada punto del diagrama representa un par de valores de p y T (presión y temperatura). En cada punto, sólo puede existir una fase, excepto sobre las líneas, donde pueden coexistir dos fases en equilibrio de fases.Estas líneas dividen el diagrama en regiones de: sólido, líquido y vapor. Las tres curvas (vaporización, fusión y sublimación), se unen en el punto triple, es la única condición en que pueden coexistir las tres fases.
Puntos de fusión y ebullición de la materia
Los puntos de fusión y de ebullición son dos constantes físicas muy usadas y pedidas en los cursos de Química y Física.
Punto de Fusión: Es la temperatura en la cual se verifica el cambio de estado físico de solido a liquido. Por ejemplo el hielo que se derrite y se transforma en agua líquida a 0°C a una atmósfera o 760 mm de Hg (mercurio) de presión . Cada sustancia tiene su punto o temperatura de fusión propia. Otro ejemplo lo constituyen los metales que también tienen una temperatura específica en la cual comienzan a pasar al estado líquido.
Punto de ebullición: Es la temperatura en la cual se verifica el pasaje del estado líquido al estado de vapor o gas. Volviendo al ejemplo del agua, lo podemos observar cuando pasa de agua líquida a vapor de agua. En este caso el punto es de 100 °C siempre y cuando la presión sea del valor de una atmósfera.
omo vemos el valor de los puntos de fusión y ebullición están afectados por el valor de la presión atmosférica. Es decir depende de esta. Por norma siempre se verán los valores en las tablas de estas constantes que están referidas o medidas a 1 atmósfera.
La importancia de saber los valores de los puntos de ebullición y de fusión tiene que ver con la identidad de una sustancia. Por ejemplo, el punto de fusión del aluminio es de 660,3 °C. No hay otra sustancia que tenga exactamente este mismo punto de fusión lo cual le da una gran importancia a la identidad del aluminio como tal. Lo mismo pasa con los puntos de ebullición. Estas constantes son propiedades intensivas como hemos explicado el concepto de las propiedades intensivas como aquellas que no varían con la cantidad de materia.
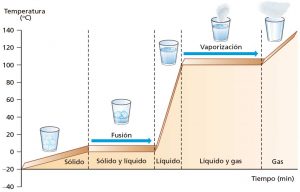
Cambios de fase de la materiaSon los procesos en los que un estado de la materia cambia a otro manteniendo una semejanza en su composición.
Los cambios de estado están divididos generalmente en dos tipos: progresivos y regresivos.
Cambios progresivos: Vaporización, fusión y sublimación progresiva.
Cambios regresivos: Condensación, solidificación y sublimación regresiva.
A continuación se describen los diferentes cambios de estado o transformaciones de fase de la materia:
- Fusión: Es el paso de un sólido al estado líquido por medio del calor; durante este proceso endotérmico (proceso que absorbe energía para llevarse a cabo este cambio) hay un punto en que la temperatura permanece constante. El “punto de fusión” es la temperatura a la cual el sólido se funde, por lo que su valor es particular para cada sustancia. Dichas moléculas se moverán en una forma independiente, transformándose en un líquido. Un ejemplo podría ser un hielo derritiéndose, pues pasa de estado sólido al líquido.
- Solidificación: Es el paso de un líquido a sólido por medio del enfriamiento; el proceso es exotérmico. El “punto de solidificación” o de congelación es la temperatura a la cual el líquido se solidifica y permanece constante durante el cambio, y coincide con el punto de fusión si se realiza de forma lenta (reversible); su valor es también específico.
- Vaporización y ebullición: Son los procesos físicos en los que un líquido pasa a estado gaseoso. Si se realiza cuando la temperatura de la totalidad del líquido iguala al punto de ebullición del líquido a esa presión continuar calentándose el líquido, éste absorbe el calor, pero sin aumentar la temperatura: el calor se emplea en la conversión del agua en estado líquido en agua en estado gaseoso, hasta que la totalidad de la masa pasa al estado gaseoso. En ese momento es posible aumentar la temperatura del gas.
- Condensación: Se denomina condensación al cambio de estado de la materia que se pasa de forma gaseosa a forma líquida. Es el proceso inverso a la vaporización. Si se produce un paso de estado gaseoso a estado sólido de manera directa, el proceso es llamado sublimación inversa. Si se produce un paso del estado líquido a sólido se denomina solidificación.
- Sublimación: Es el proceso que consiste en el cambio de estado de la materia sólida al estado gaseoso sin pasar por el estado líquido. Al proceso inverso se le denomina Sublimación inversa; es decir, el paso directo del estado gaseoso al estado sólido. Un ejemplo clásico de sustancia capaz de sublimarse es el hielo seco.
- Deionización: Es el cambio de un plasma a gas.
- Ionización: Es el cambio de un gas a un plasma. Es importante hacer notar que en todas las transformaciones de fase de las sustancias, éstas no se transforman en otras sustancias, solo cambia su estado físico.
Los gases
¿Qué son los gases?
Esto se determina empleando la fórmula Q = m . Ce . Δt, en donde m será la masa del cuerpo, Ce su calor específico expresado en cal / gr °C, y Δt la variación de temperatura, o sea: Δt = tf – ti, tiempo final menos tiempo inicial.
Una vez calculado el calor Q para cada cuerpo, podremos compararlos a sabiendas de que el equilibrio térmico se da en la igualdad de las temperaturas entre el cuerpo 1 y el cuerpo 2. Para llegar al equilibrio térmico, el calor que el cuerpo más frío gana es el que el cuerpo más caliente pierde, así que Q1 = Q2, o sea, calor ganado = calor perdido.
Transmisión del calor
En general, se reconocen tres modos distintos de transferencia de calor: conducción, convección y radiación, aunque, en rigor, solo la conducción y radiación debieran considerarse formas de transmisión de calor, porque solo ellas dependen exclusivamente de un desequilibrio térmico para producirse. Para que se produzca convección, tiene que haber un transporte mecánico de masa además de una diferencia de temperatura, sin embargo, teniendo en cuenta que la convección también transfiere energía de zonas con mayor temperatura a zonas con menor temperatura, normalmente se admite el modo transferencia de calor por convección.
Conducción: Es la transferencia de calor que se produce a través de un medio material por contacto directo entre sus partículas, cuando existe una diferencia de temperatura y en virtud del movimiento de sus micropartículas. El medio puede ser sólido, líquido o gaseoso, aunque en líquidos y gases solo se da la conducción pura si se excluye la posibilidad de convección. La cantidad de calor que se transfiere por conducción, viene dada por la ley de Fourier. Esta ley afirma que la velocidad de conducción de calor a través de un cuerpo por unidad de sección transversal, es proporcional al gradiente de temperatura que existe en el cuerpo.
Convección: La transmisión de calor por convección se compone de dos mecanismos simultáneos. El primero, es la transferencia de calor por conducción, debido al movimiento molecular, a la que se superpone la transferencia de energía por el movimiento de fracciones del fluido que se mueven accionadas por una fuerza externa, que puede ser un gradiente de densidad (convección natural), o una diferencia de presión producida mecánicamente (convección forzada) o una combinación de ambas. La cantidad de calor transferido por convección, se rige por la ley de enfriamiento de Newton.
Dilatación térmica
La dilatación térmica es el proceso por el cual los cuerpos aumentan su volumen cuando se aumenta su temperatura.
Cuando en lugar de aumentar, la temperatura disminuye, el volumen del cuerpo también lo hace, hablándose en estos casos de contracción térmica.
Estos fenómenos son especialmente importantes a la hora de fabricar determinadas estructuras como por ejemplo las vías de tren. Las industrias que fabrican los rieles los entregan con una longitud de unos 12 m. Es necesario unirlos (generalmente abulonados) para formar las vías. Durante el día la temperatura ambiente que pueden llegar a soportar ronda entorno a los 40° e incluso el acero puede alcanzar una temperatura muy superior. Dicha temperatura provoca dilataciones en las vías favoreciendo que en las uniones se provoquen deformaciones. Por esta razón, justamente en dichas uniones se deja una separación de unos 5 mm denominado junta de dilatación.

El problema de esta separación es que es incompatible con el desplazamiento de los trenes de alta velocidad (250 km/h) ya que generan mucho ruido al circular el tren por ellas y las ruedas y rieles sufrirían roturas. La tecnología moderna ha logrado soldaduras especiales que absorben las dilataciones, por lo tanto hay tramos de muchos kilómetros (varias decenas) sin separaciones aunque en las cercanías de las estaciones de ferrocarril se siguen utilizando ya que por esas zonas los trenes deben disminuir mucho su velocidad.
Webgrafía
Tema 4. Fases de la materia
La materia puede existir en varias formas o estados de agregación diferentes, conocidos como fases, dependiendo del volumen y de la presión y temperatura ambiente. Una fase es una forma de materia que tiene una composición química y unas propiedades físicas relativamente uniformes. Estas fases incluyen las tres familiares (sólidos, líquidos, y gases), así como otros estados más exóticos de la materia (como plasmas, superfluidos, supersólidos).
Estas líneas dividen el diagrama en regiones de: sólido, líquido y vapor. Las tres curvas (vaporización, fusión y sublimación), se unen en el punto triple, es la única condición en que pueden coexistir las tres fases.
Puntos de fusión y ebullición de la materia
Los puntos de fusión y de ebullición son dos constantes físicas muy usadas y pedidas en los cursos de Química y Física.
Punto de Fusión: Es la temperatura en la cual se verifica el cambio de estado físico de solido a liquido. Por ejemplo el hielo que se derrite y se transforma en agua líquida a 0°C a una atmósfera o 760 mm de Hg (mercurio) de presión . Cada sustancia tiene su punto o temperatura de fusión propia. Otro ejemplo lo constituyen los metales que también tienen una temperatura específica en la cual comienzan a pasar al estado líquido.
Punto de ebullición: Es la temperatura en la cual se verifica el pasaje del estado líquido al estado de vapor o gas. Volviendo al ejemplo del agua, lo podemos observar cuando pasa de agua líquida a vapor de agua. En este caso el punto es de 100 °C siempre y cuando la presión sea del valor de una atmósfera.
omo vemos el valor de los puntos de fusión y ebullición están afectados por el valor de la presión atmosférica. Es decir depende de esta. Por norma siempre se verán los valores en las tablas de estas constantes que están referidas o medidas a 1 atmósfera.
La importancia de saber los valores de los puntos de ebullición y de fusión tiene que ver con la identidad de una sustancia. Por ejemplo, el punto de fusión del aluminio es de 660,3 °C. No hay otra sustancia que tenga exactamente este mismo punto de fusión lo cual le da una gran importancia a la identidad del aluminio como tal. Lo mismo pasa con los puntos de ebullición. Estas constantes son propiedades intensivas como hemos explicado el concepto de las propiedades intensivas como aquellas que no varían con la cantidad de materia.
Son los procesos en los que un estado de la materia cambia a otro manteniendo una semejanza en su composición.
Los cambios de estado están divididos generalmente en dos tipos: progresivos y regresivos.
Cambios progresivos: Vaporización, fusión y sublimación progresiva.
Cambios regresivos: Condensación, solidificación y sublimación regresiva.
A continuación se describen los diferentes cambios de estado o transformaciones de fase de la materia:
- Fusión: Es el paso de un sólido al estado líquido por medio del calor; durante este proceso endotérmico (proceso que absorbe energía para llevarse a cabo este cambio) hay un punto en que la temperatura permanece constante. El “punto de fusión” es la temperatura a la cual el sólido se funde, por lo que su valor es particular para cada sustancia. Dichas moléculas se moverán en una forma independiente, transformándose en un líquido. Un ejemplo podría ser un hielo derritiéndose, pues pasa de estado sólido al líquido.
- Solidificación: Es el paso de un líquido a sólido por medio del enfriamiento; el proceso es exotérmico. El “punto de solidificación” o de congelación es la temperatura a la cual el líquido se solidifica y permanece constante durante el cambio, y coincide con el punto de fusión si se realiza de forma lenta (reversible); su valor es también específico.
- Vaporización y ebullición: Son los procesos físicos en los que un líquido pasa a estado gaseoso. Si se realiza cuando la temperatura de la totalidad del líquido iguala al punto de ebullición del líquido a esa presión continuar calentándose el líquido, éste absorbe el calor, pero sin aumentar la temperatura: el calor se emplea en la conversión del agua en estado líquido en agua en estado gaseoso, hasta que la totalidad de la masa pasa al estado gaseoso. En ese momento es posible aumentar la temperatura del gas.
- Condensación: Se denomina condensación al cambio de estado de la materia que se pasa de forma gaseosa a forma líquida. Es el proceso inverso a la vaporización. Si se produce un paso de estado gaseoso a estado sólido de manera directa, el proceso es llamado sublimación inversa. Si se produce un paso del estado líquido a sólido se denomina solidificación.
- Sublimación: Es el proceso que consiste en el cambio de estado de la materia sólida al estado gaseoso sin pasar por el estado líquido. Al proceso inverso se le denomina Sublimación inversa; es decir, el paso directo del estado gaseoso al estado sólido. Un ejemplo clásico de sustancia capaz de sublimarse es el hielo seco.
- Deionización: Es el cambio de un plasma a gas.
- Ionización: Es el cambio de un gas a un plasma. Es importante hacer notar que en todas las transformaciones de fase de las sustancias, éstas no se transforman en otras sustancias, solo cambia su estado físico.
Los gases
¿Qué son los gases?
Con el término gas nos referimos a uno de los tres principales estados de agregación de la materia (junto a los líquidos y los sólidos). Se caracteriza por la dispersión, fluidez y poca atracción entre sus partículas constitutivas.
Los gases son la forma más volátil de la materia en la naturaleza y son sumamente comunes en la vida cotidiana.
Cuando una sustancia se encuentra en estado gaseoso solemos llamarla gas o vapor y sabemos que sus propiedades físicas han cambiado. Sin embargo, no cambian las propiedades químicas: la sustancia sigue estando compuesta por los mismos átomos.
Leyes de los gases
El comportamiento de los gases es descripta por la Ley de los gases ideales, que a su vez puede comprenderse como la unión de otras leyes:- Ley de Boyle. “El volumen de un gas varía de forma inversamente proporcional a la presión si la temperatura permanece constante.” Se expresa según la fórmula: P1xV1 = P2xV2.
- Ley de Gay-Lussac. Explica que la presión de una masa de gas cuyo volumen se mantiene constante es directamente proporcional a la temperatura que posea. Esto se formula de la siguiente manera: P1/T1 = P2/T2.
- Ley de Charles. Expresa la relación constante entre la temperatura y el volumen de un gas, cuando la presión es constante. Su fórmula es: V1 / T1 = V2 /T2.
- Ley de Avogadro. “En iguales condiciones de presión y temperatura, las densidades relativas de los cuerpos gaseosos son proporcionales a sus números atómicos”.
Tipos de gases
Con el término gas nos referimos a uno de los tres principales estados de agregación de la materia (junto a los líquidos y los sólidos). Se caracteriza por la dispersión, fluidez y poca atracción entre sus partículas constitutivas.
Los gases son la forma más volátil de la materia en la naturaleza y son sumamente comunes en la vida cotidiana.
Cuando una sustancia se encuentra en estado gaseoso solemos llamarla gas o vapor y sabemos que sus propiedades físicas han cambiado. Sin embargo, no cambian las propiedades químicas: la sustancia sigue estando compuesta por los mismos átomos.
Leyes de los gases
- Ley de Boyle. “El volumen de un gas varía de forma inversamente proporcional a la presión si la temperatura permanece constante.” Se expresa según la fórmula: P1xV1 = P2xV2.
- Ley de Gay-Lussac. Explica que la presión de una masa de gas cuyo volumen se mantiene constante es directamente proporcional a la temperatura que posea. Esto se formula de la siguiente manera: P1/T1 = P2/T2.
- Ley de Charles. Expresa la relación constante entre la temperatura y el volumen de un gas, cuando la presión es constante. Su fórmula es: V1 / T1 = V2 /T2.
- Ley de Avogadro. “En iguales condiciones de presión y temperatura, las densidades relativas de los cuerpos gaseosos son proporcionales a sus números atómicos”.
Tipos de gases
Los gases pueden clasificarse según su naturaleza química en:
- Combustibles o inflamables. Aquellos que pueden arder, esto es, generar reacciones explosivas o exotérmicas en presencia del oxígeno u otros oxidantes.
- Corrosivos. Aquellos que al entrar en contacto con otras sustancias las someten a procesos de reducción u oxidación intensos, generando daños en su superficie o heridas en caso de ser materia orgánica.
- Comburentes. Aquellos que permiten mantener viva una llama o una reacción inflamable, ya que inducen la combustión en otras sustancias.
- Tóxicos. Aquellos que representan un peligro para la salud por las reacciones que introducen en el cuerpo de los seres vivos, como los gases radiactivos.
- Inertes o nobles. Aquellos que presentan poca o nula reactividad, excepto en situaciones y condiciones determinadas.
- Ideales. No son realmente gases sino un concepto ideal y de trabajo respecto a cómo tendrían que comportarse los gases. Una abstracción.
Los gases pueden clasificarse según su naturaleza química en:
- Combustibles o inflamables. Aquellos que pueden arder, esto es, generar reacciones explosivas o exotérmicas en presencia del oxígeno u otros oxidantes.
- Corrosivos. Aquellos que al entrar en contacto con otras sustancias las someten a procesos de reducción u oxidación intensos, generando daños en su superficie o heridas en caso de ser materia orgánica.
- Comburentes. Aquellos que permiten mantener viva una llama o una reacción inflamable, ya que inducen la combustión en otras sustancias.
- Tóxicos. Aquellos que representan un peligro para la salud por las reacciones que introducen en el cuerpo de los seres vivos, como los gases radiactivos.
- Inertes o nobles. Aquellos que presentan poca o nula reactividad, excepto en situaciones y condiciones determinadas.
- Ideales. No son realmente gases sino un concepto ideal y de trabajo respecto a cómo tendrían que comportarse los gases. Una abstracción.
La evaporación es un proceso de cambio de fase sumamente común, que conduce a un líquido a convertirse en gas, mediante la añadidura de energía (calor).
La ponemos en práctica a diario en la cocina, cada vez que hervimos agua, por ejemplo, o en la ducha cuando el agua muy caliente se convierte en vapor observable como una nube blanquecina.
La evaporación es un proceso de cambio de fase sumamente común, que conduce a un líquido a convertirse en gas, mediante la añadidura de energía (calor).
La ponemos en práctica a diario en la cocina, cada vez que hervimos agua, por ejemplo, o en la ducha cuando el agua muy caliente se convierte en vapor observable como una nube blanquecina.
Condensación de los gases
La condensación es el proceso opuesto a la evaporación, esto es, un proceso de cambio de fase que conduce del estado gaseoso al líquido, debido a la pérdida de energía calórica.
Esta energía perdida hace que las partículas del gas vibren más despacio, permitiéndoles aproximarse y enlazarse más estrechamente, como ocurre sobre un vidrio frío en día lluvioso, o sobre las plantas y otras superficies con el rocío.
La condensación es el proceso opuesto a la evaporación, esto es, un proceso de cambio de fase que conduce del estado gaseoso al líquido, debido a la pérdida de energía calórica.
Esta energía perdida hace que las partículas del gas vibren más despacio, permitiéndoles aproximarse y enlazarse más estrechamente, como ocurre sobre un vidrio frío en día lluvioso, o sobre las plantas y otras superficies con el rocío.
Sublimación inversa de los gases
La sublimación inversa, como su nombre lo indica, es el camino opuesto de la sublimación, o sea, el paso del estado gaseoso al estado sólido sin pasar primero por un momento de liquidez.
Este proceso requiere de condiciones de presión y temperatura muy específicas.
Cuando las sustancias puras en estado gaseoso se solidifican en forma de cristales, se denomina cristalización. Es el caso de los cristales de hielo que caen durante las nevadas.
Bibliografía
1. https://sites.google.com/site/portafolio54037/fases-de-la-materia
2. https://quimicayalgomas.com/fisica/puntos-fusion-ebullicion/
4. https://www.caracteristicas.co/gases/
Septiembre 24, de 2020Tema 5. Leyes de la termodinámica
Las leyes de la termodinámica son un conjunto de leyes sobre
las que se basa la termodinámica. En concreto, se trata de cuatro leyes que son
universalmente válidas cuando se aplican a sistemas que caen dentro de las
restricciones implícitas en cada uno.
Leyes de la termodinámica
Ley cero de la termodinámicaA este principio se llama del equilibrio termodinámico. Si
dos sistemas A y B están en equilibrio termodinámico, y B está en equilibrio
termodinámico con un tercer sistema C, entonces A y C están a su vez en
equilibrio termodinámico.
Este principio es fundamental. El principio 0 no fue
formulado formalmente hasta después de haber enunciado las otras tres leyes. De
ahí que recibe la posición 0.
¿Qué significa que un proceso está en equilibrio
termodinámico?
El equilibrio termodinámico de un sistema termodinámico se
define como la condición del mismo en el que las variables empíricas utilizadas
para definir un estado del sistema han llegado a un punto de equilibrio. Al
estar en equilibrio, no varían a lo largo del tiempo.
A estas variables empíricas (experimentales) de un sistema
se les conoce como coordenadas termodinámicas del sistema. Entre otras
variables empíricas tenemos: presión, volumen, campo eléctrico, polarización,
magnetización, tensión lineal, tensión superficial, etc.
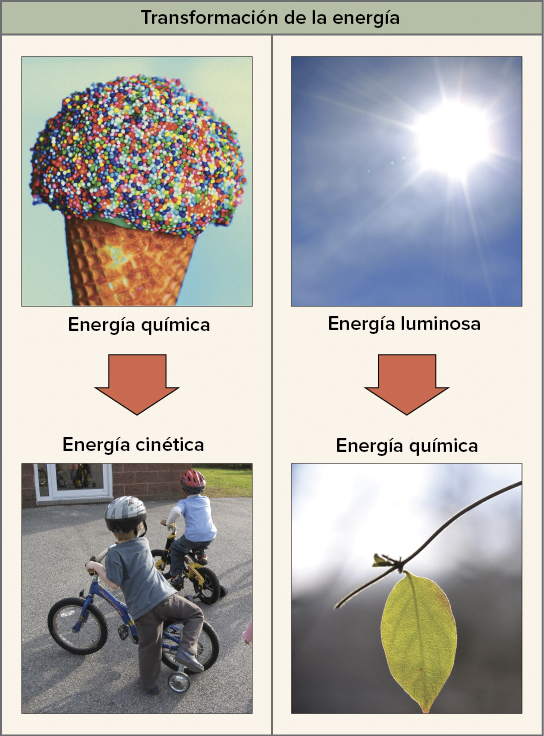
La primera ley de la termodinámica
La primera ley de la termodinámica piensa en grande: se
refiere a la cantidad total de energía en el universo, y en particular declara
que esta cantidad total no cambia. Dicho de otra manera, la Primera ley de la
termodinámica dice que la energía no se puede crear ni destruir, solo puede
cambiarse o transferirse de un objeto a otro.
Esta ley puede parecer algo abstracta, pero si empezamos a
ver los ejemplos, encontraremos que las transferencias y transformaciones de
energía ocurren a nuestro alrededor todo el tiempo. Por ejemplo:
- ·
Los focos transforman energía eléctrica en
energía luminosa (energía radiante).
- Una bola de billar golpea a otra, lo que
transfiere energía cinética y hace que la segunda bola se mueva.
- Las plantas convierten la energía solar (energía
radiante) en energía química almacenada en moléculas orgánicas.
- Tú estas transformando la energía química de tu
última comida en energía cinética cuando caminas, respiras y mueves tu dedo
para desplazarte hacia arriba y hacia abajo por esta página.
Segunda ley de la termodinámicaLa segunda ley de la termodinámica regula la dirección en
que se han de llevar a cabo los procesos termodinámicos y, por tanto, la
imposibilidad de que ocurran en el sentido contrario. Por ejemplo, la
transferencia de calor se puede producir de un cuerpo caliente a otro frío,
pero no a la inversa.
También establece, en algunos casos, la imposibilidad de
convertir completamente toda la energía de un tipo a otro sin pérdidas. Por
ejemplo, en un motor ideal, la cantidad de calor suministrada se convierte en
trabajo mecánico. Sin embargo, en un motor real, parte del calor suministrado
se pierde.
Esta ley permite definir la entropía. La variación de la
cantidad de entropía de un sistema termodinámico aislado siempre debe ser mayor
o igual a cero y sólo es igual a cero si el proceso es reversible.
Tercera ley de la termodinámicaLa tercera de las leyes de la termodinámica afirma que es
imposible alcanzar una temperatura igual al cero absoluto mediante un número
finito de procesos físicos. El cero absoluto equivale a 0 kelvin, es decir, a
-273 grados Celsius. Esta ley fue propuesta por Walther Nernst.
Cuando la temperatura tiende a cero absoluto, la entropía de
cualquier sistema tiende a cero
El tercer principio de la termodinámica puede formular
también como que a medida que un sistema dado se aproxima al cero absoluto, su
entropía tiende a un valor constante específico.
La sublimación inversa, como su nombre lo indica, es el camino opuesto de la sublimación, o sea, el paso del estado gaseoso al estado sólido sin pasar primero por un momento de liquidez.
Este proceso requiere de condiciones de presión y temperatura muy específicas.
Cuando las sustancias puras en estado gaseoso se solidifican en forma de cristales, se denomina cristalización. Es el caso de los cristales de hielo que caen durante las nevadas.
Bibliografía
1. https://sites.google.com/site/portafolio54037/fases-de-la-materia
2. https://quimicayalgomas.com/fisica/puntos-fusion-ebullicion/
4. https://www.caracteristicas.co/gases/
Tema 5. Leyes de la termodinámica
Las leyes de la termodinámica son un conjunto de leyes sobre
las que se basa la termodinámica. En concreto, se trata de cuatro leyes que son
universalmente válidas cuando se aplican a sistemas que caen dentro de las
restricciones implícitas en cada uno.
Leyes de la termodinámica
A este principio se llama del equilibrio termodinámico. Si
dos sistemas A y B están en equilibrio termodinámico, y B está en equilibrio
termodinámico con un tercer sistema C, entonces A y C están a su vez en
equilibrio termodinámico.
Este principio es fundamental. El principio 0 no fue
formulado formalmente hasta después de haber enunciado las otras tres leyes. De
ahí que recibe la posición 0.
El equilibrio termodinámico de un sistema termodinámico se
define como la condición del mismo en el que las variables empíricas utilizadas
para definir un estado del sistema han llegado a un punto de equilibrio. Al
estar en equilibrio, no varían a lo largo del tiempo.
A estas variables empíricas (experimentales) de un sistema
se les conoce como coordenadas termodinámicas del sistema. Entre otras
variables empíricas tenemos: presión, volumen, campo eléctrico, polarización,
magnetización, tensión lineal, tensión superficial, etc.
La primera ley de la termodinámica
La primera ley de la termodinámica piensa en grande: se
refiere a la cantidad total de energía en el universo, y en particular declara
que esta cantidad total no cambia. Dicho de otra manera, la Primera ley de la
termodinámica dice que la energía no se puede crear ni destruir, solo puede
cambiarse o transferirse de un objeto a otro.
Esta ley puede parecer algo abstracta, pero si empezamos a
ver los ejemplos, encontraremos que las transferencias y transformaciones de
energía ocurren a nuestro alrededor todo el tiempo. Por ejemplo:
- · Los focos transforman energía eléctrica en energía luminosa (energía radiante).
- Una bola de billar golpea a otra, lo que transfiere energía cinética y hace que la segunda bola se mueva.
- Las plantas convierten la energía solar (energía radiante) en energía química almacenada en moléculas orgánicas.
- Tú estas transformando la energía química de tu última comida en energía cinética cuando caminas, respiras y mueves tu dedo para desplazarte hacia arriba y hacia abajo por esta página.
La segunda ley de la termodinámica regula la dirección en
que se han de llevar a cabo los procesos termodinámicos y, por tanto, la
imposibilidad de que ocurran en el sentido contrario. Por ejemplo, la
transferencia de calor se puede producir de un cuerpo caliente a otro frío,
pero no a la inversa.
También establece, en algunos casos, la imposibilidad de
convertir completamente toda la energía de un tipo a otro sin pérdidas. Por
ejemplo, en un motor ideal, la cantidad de calor suministrada se convierte en
trabajo mecánico. Sin embargo, en un motor real, parte del calor suministrado
se pierde.
Esta ley permite definir la entropía. La variación de la
cantidad de entropía de un sistema termodinámico aislado siempre debe ser mayor
o igual a cero y sólo es igual a cero si el proceso es reversible.
La tercera de las leyes de la termodinámica afirma que es
imposible alcanzar una temperatura igual al cero absoluto mediante un número
finito de procesos físicos. El cero absoluto equivale a 0 kelvin, es decir, a
-273 grados Celsius. Esta ley fue propuesta por Walther Nernst.
Cuando la temperatura tiende a cero absoluto, la entropía de
cualquier sistema tiende a cero
El tercer principio de la termodinámica puede formular
también como que a medida que un sistema dado se aproxima al cero absoluto, su
entropía tiende a un valor constante específico.



Comentarios